Si está utilizando este medicamento, llame a su médico, la FDA advierte
El uso de este tratamiento retirado podría conducir a complicaciones "potencialmente mortales".

Para la mayoría de nosotros, los medicamentos son parte de la vida cotidiana: puede tomar una píldora diaria para tratar las alergias estacionales o confiar en el tratamiento de recetas para mantener una enfermedad más grave bajo control. Entonces, cuando un medicamento esSujeto a retiroEs comprensible que sea un poco desconcertante. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) acaba de anunciar que se está retirando un medicamento, y si lo está utilizando ahora, querrá comunicarse con su médico para obtener orientación. Siga leyendo para averiguar de qué se advierte la agencia.
Lea esto a continuación:Este medicamento diario común puede ser más difícil de encontrar, dicen los fabricantes.
Varios medicamentos recetados han estado sujetos a retiro este año.

Durante el verano, se extrajeron varios medicamentos de los estantes, incluidostabletas de morfina Fabricado por Bryant Ranch Prepack Inc. Según el anuncio de retiro del 29 de junio de la FDA, las tabletas fueron retiradas debido a unProblema con las etiquetas. Las tabletas de liberación extendida de sulfato de morfina se etiquetaron mal como tabletas de 60 mg, y las tabletas de liberación extendida de sulfato de morfina se etiquetaron mal como 30 mg.
Como resultado de la confusión, los pacientes recetaron la dosis de 30 mg podrían tomar por error las tabletas de 60 mg y ponerse en riesgo de sobredosis y muerte. Y las tabletas recetadas de 60 mg que toman tabletas de 30 mg podrían estar en riesgo de retirarse, así como dolor no tratado, advirtió la FDA. Se pidió a los pacientes con medicamentos que dejaran de usarlo de inmediato y que se comunicaran con el fabricante.
En julio, los pacientes con diabetes trataron un retiro significativo, cuandoUn lote de insulina Glargine (Inyección de insulina Glargine-YFGN), 100 unidades/ml (U-100) fueronrecordado voluntariamente por Mylan Pharmaceuticals Inc. Esto se debió nuevamente a un problema de etiquetado, según el anuncio de la FDA, ya que se descubrió que algunas plumas de insulina faltaban etiquetas. Los pacientes podrían experimentar "complicaciones graves" si los productos se mezclaran con diferentes tipos de insulina, y se les indicó que llamara a la firma de gestión de retiro Sedgwick.
Pero el retiro más reciente no es el resultado de los problemas de etiquetado, en realidad se debe a la posible contaminación.
Este medicamento se usa para tratar una infección viral común.

El 26 de septiembre, elFDA anunciado que Eugia Us LLC (anteriormenteAuromedics Pharma LLC), una compañía con sede en East Windsor, Nueva Jersey, emitió un retiro voluntario de un lote de inyección de aciclovir sodio de Auromedics 500 mg por 10 ml (50 mg/ml), 10 ml de vial dosis única. El medicamento es conocido por elmarca Zovirax.AE0FCC31AE342FD3A1346EBB1F342FCB
El medicamento contiene aciclovir, que es un tratamiento utilizado para los virus del herpes, declaró la FDA. La inyección se usa para tratar "herpes simplex de mucosa y cutánea inicial y recurrente (HSV-1 y HSV-2)" en pacientes que están inmunocomprometidos, así como "episodios clínicos iniciales del herpes genital en pacientes inmunocompetentes," lo que significa aquellos que tienen que tienen una respuesta inmune normal.
El herpes simple cutáneo puede causar lesiones en la piel, mientras que el herpes mucoso simpleafecta a la mucosa, que es el "tejido blando que recubre los canales y los órganos del cuerpo", según la Clínica Cleveland.
RELACIONADO:Para obtener información más actualizada, regístrese en nuestro boletín diario.
Consulte su producto para ver si es parte del retiro.
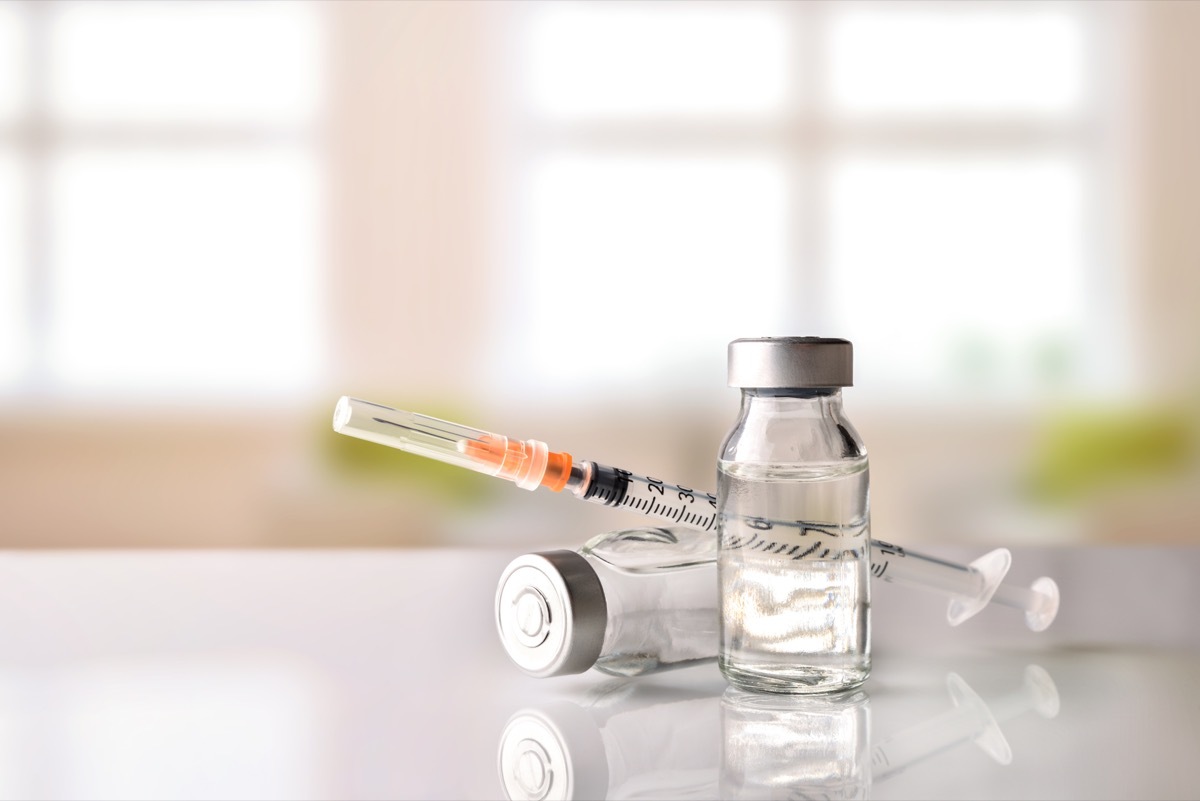
Según el anuncio de la FDA, el retiro afecta el número de lote AC22006, que tiene una fecha de vencimiento de agosto de 2023. Los productos fueron enviados a mayoristas de todo el país entre el 8 de junio y el 13 de junio, empaquetados en viales de vidrio y etiquetados con el código de drogas nacional (NDC) 55150-154-10.
Los viales están siendo retirados del mercado después de una "queja del producto", que señaló "la presencia de partículas de color rojo oscuro, marrón y negro dentro del vial".
Eugia US LLC no ha recibido ningún informe de eventos adversos relacionados con el lote retirado. Sin embargo, los productos que contienen estas partículas podrían conducir a "inflamación, reacciones alérgicas o complicaciones del sistema circulatorio" que podrían ser potencialmente mortales, señala la FDA.
Llame al médico si tiene este medicamento en casa.

Si tiene un producto retirado del mercado en su botiquín, y especialmente si experimenta algún problema de salud relacionado con el producto, la FDA le pide que llame a su médico. Los consumidores también deben llamar a Qualanex (que brinda servicios de soporte para Eugia) al 1-888-280-2046 entre las 7 a.m. y las 4 p.m. Hora estándar central, de lunes a viernes, o envíe un correo electrónico a la compañía a[Correo electrónico protegido]
Según el anuncio de retiro, Eugia US LLC está enviando cartas de retiro a quienes recibieron el producto, organizando el regreso y el reemplazo. Se les pide a los mayoristas y a los profesionales de la salud que pongan el lote retirado en espera de inmediato y se comuniquen con Qualanex.
Los consumidores pueden informar problemas de calidad y reacciones adversas a la FDA Informes de eventos adversos de MedWatch programa en línea o por correo o fax regular .

Es por eso que el hijo de Tom Hanks está bajo fuego otra vez.

Tienda de ultramarinos 7 cosas que usted pudo nunca hacer de nuevo
