Si vous utilisez ce médicament quotidien, la FDA a un nouvel avertissement urgent.
Les fonctionnaires rappellent un produit en raison d'un risque de santé potentiel.

Toute personne qui vit avec un état de santé chronique est probablement familière avec unroutine quotidienne de médicaments. Heureusement, de tels produits peuvent atténuer les symptômes ouaider à éviter les urgences de santé majeures afin qu'il soit possible d'aller sur une vie relativement normale. Mais maintenant, la Food & Drug Administration (FDA) a publié un avertissement pour un médicament quotidien que vous voudrez peut-être savoir. Lisez-y pour voir quel produit est tiré en raison d'un risque potentiel sur la santé.
EN RELATION:Ces brûlures d'estomac et ces médicaments contre la douleur ont été rappelées, la FDA avertit.
Mylan Pharmaceuticals a publié un rappel volontaire d'un lot de son injection d'insuline glargine.
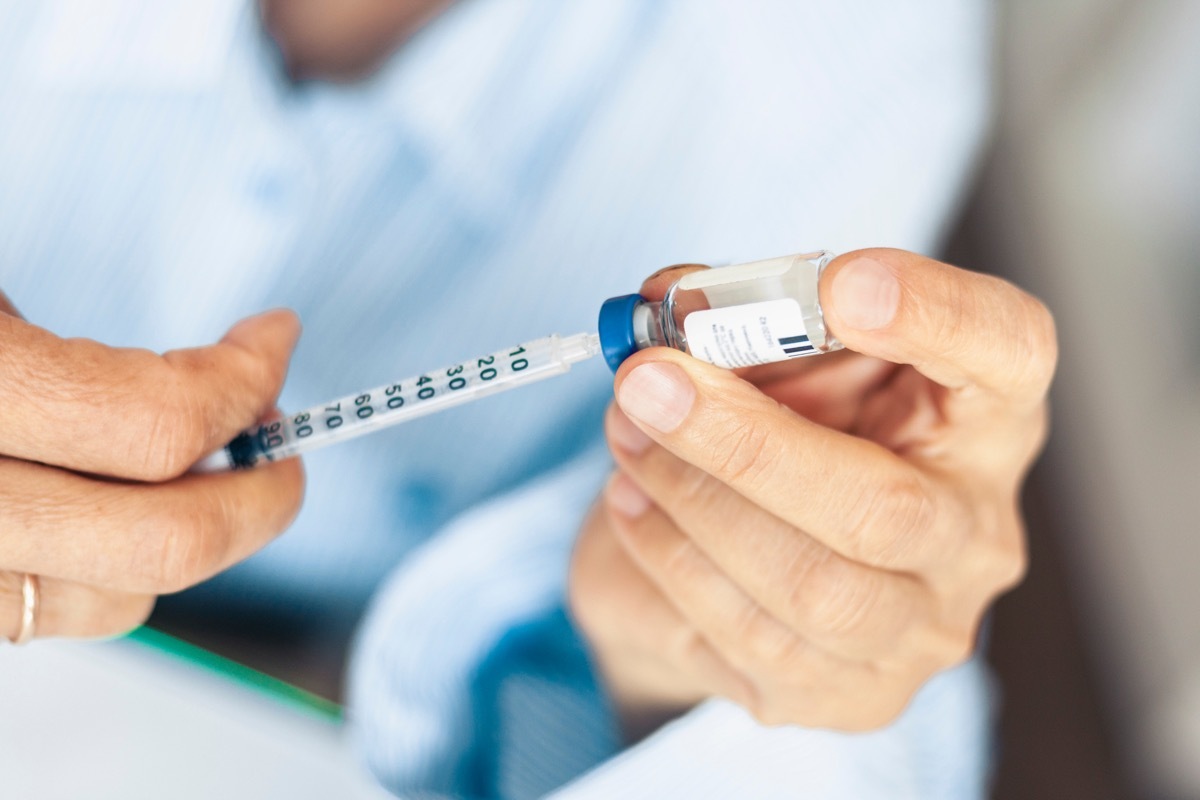
Le 12 avril, la FDA a annoncé que Mylan Pharmaceuticals Inc. rappelle volontairement un lot de sonInsuline Glargine (insuline glargine-yfgn) injection, 100 unités / ml (U-100). Le produit est emballé dans 10 ml de flacons emballés dans un carton. Mylan Specialty L.P. a distribué les produits concernés aux États-Unis entre le 9 décembre 2021 et le 4 mars 2022.AE0FCC31AE342FD3A1346EBB1F342FCB
Les articles rappelés peuvent être identifiés par NDC Numéro 49502-393-80, numéro de lot BF21002800 et la date d'expiration du 20 août 2023 imprimée sur le carton dans lequel il a été expédié. De plus, l'avis précise que le rappel affecte le flacon de l'insuline-glargine-YFNGN non annoncé et non de l'injection biosimilaire interchangeable interchangeable (insuline glargine-yfgn).
L'insuline est rappelée en raison d'étiquettes manquantes sur certaines flacons.

Selon l'avis, Mylan Pharmaceuticals a publié le rappel d'insuline après avoir découvert que le lot en question pourrait potentiellement être des étiquettes manquantes sur certaines flacons. Cela pourrait créer unRisque de santé potentiel Pour les adultes et les enfants avec le diabète de type 1 et 2 de type 2 qui utilisent le médicament quotidiennement pour améliorer le contrôle glycémique.
"Pour les patients recevant un traitement avec plus d'un type d'insuline (par exemple, une insuline à effet courte et longue), une étiquette manquante sur les flacons de glargine d'insuline pourrait conduire à un mélange de produits / de forces, ce qui peut entraîner une glycémie moins optimale. Contrôle (glycémie élevée ou faible) qui pourrait entraîner des complications graves », la FDA met en garde.
EN RELATION:Pour plus d'informations à jour, inscrivez-vous à notre newsletter quotidien.
Voici ce que les grossistes et les détaillants médicaux devraient faire si elles ont les flacons rappelés.

La FDA conseille à tous les détaillants d'examiner leur inventaire pour vérifier immédiatement le produit rappelé. Si cela est trouvé, mettez-le en quarantaine et interrompez la distribution du lot.
Les grossistes de l'offre médicale devraient également examiner leur inventaire, leur quarantaine et cesser la distribution du produit rappelé. Ils devraient ensuite alerter tous les clients qui ont peut-être reçu le produit rappelé, y compris les clients de détail. Une liste de tous les acheteurs potentiels du produit rappelé doit également être effectuée dans une liste dans un fichier Microsoft Excel et envoyé par courrier électronique à [email protected] dans les cinq jours ouvrables. Sedgwick (Sterricycle) utilisera ces informations pour informer vos clients de niveau de détail qui ont reçu le lot affecté.
Les clients avec des flacons rappelés doivent appeler Sterricycle pour un paquet d'expédition de retour.

Heureusement, selon la FDA, aucun événement médical indésirable lié au rappel n'a encore été rapporté. Cependant, tous les clients qui ont des flacons non étirés en leur possession doivent appeler Sterricycle au 1-888-912-7084 pour demander un paquet de documentation pour renvoyer le produit à la société.
Pour des questions générales sur le rappel, les clients peuvent appeler la hotline des relations client pour Viatris au 1-800-796-9526 en semaine de 8h00 à 5 heures. Est ou envoyer un email à [email protected]. L'Agence conseille également quiconque peut avoir connu des problèmes de santé résultant de l'utilisation du produit rappelé devrait appeler immédiatement leur médecin ou leur fournisseur de soins de santé.
EN RELATION:Si vous avez l'un de ces 7 médicaments, arrêtez de les utiliser maintenant, FDA avertit.