美国食品药物管理局刚刚批准该药物针对专家的建议
专家的外部面板警告说,没有足够的证据表明该药物是有效的。

从美国食品和药物管理局(FDA)批准看着如知道你应该能够相信一个产品的金标准。这机构的批准 指的是药物经过全面测试,并认为是安全有效的,有它的好处这超出了任何潜在的风险。一般来说,FDA的决定是在与医生和研究人员在外地咨询热线,但也有一些例外。事实上,FDA刚刚批准对外部专家的意见,一个新的药物。仔细阅读,了解更多关于这个有争议的药物。
有关的:如果你服用药物对于这一点,您可能仍然需要一个面具,CDC说。
美国食品药物管理局刚刚批准用于治疗阿尔茨海默氏对专家意见的疾病的新药。
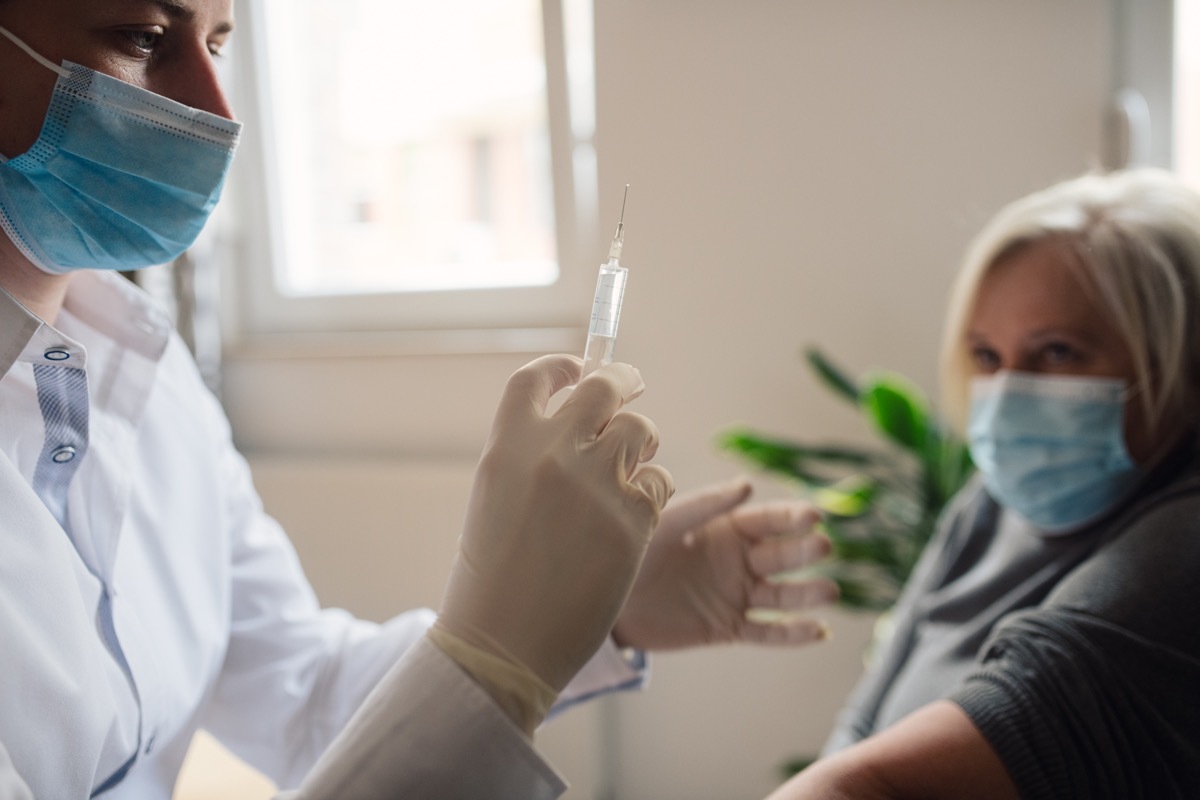
6月7日,美国食品药品管理局批准Aduhelm(aducanumab),设计用于治疗阿尔茨海默氏症的药物。根据一份声明 从FDA,这是第一次自2003年以来该机构已经批准了阿尔茨海默氏症药物的核准,外部顾问小组敦促FDA后,拒绝在11月药回来,因为它没有被证明有助于减缓该疾病的进展。
NBC新闻报道,虽然药物声称它可以减缓下降速度 在阿尔茨海默氏症患者,那也只是显示在一项研究中,该小组没有觉得是充分的证据来这样做。小组成员还指出,关于注射治疗多“红旗”。
经度施耐德医学博士,美国南加州大学,加州阿尔茨海默氏病中心主任,上aducanumab试验现场研究者之一,告诉纽约时报“有这么成效很少有证据 ......我不知道这里是什么引起了FDA的喜爱。”
美国食品药物管理局认可围绕批准的争议。
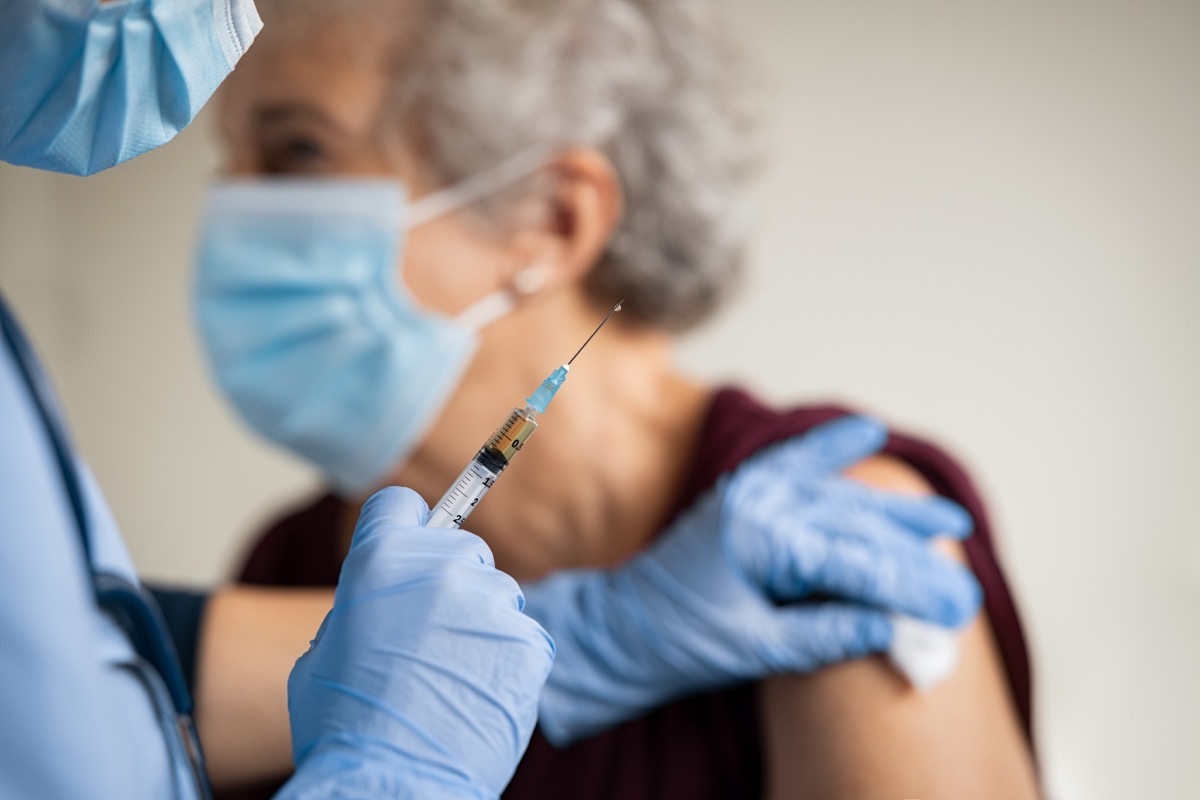
在所有这些争议,FDA要求制药商,生物遗传,至进行后续研究美联社(AP)报道。如果研究不能证明成效,FDA可以从市场上清除的药物。然而,美联社指出,该机构很少采取这一行动。
美国食品药物管理局已经承认围绕其最近的决定争。在声明中,FDA的导演的中心药物评价和研究帕特里齐亚Cavazzoni医师指出,该机构“以及感知的注意围绕这一批准。”她补充说,‘专家社区提供了不同的观点’,并在提交数据上留下了该药物的益处不确定性。
专家说,医生将不得不决定是否处方药。

杰森Karlawish医学博士,宾夕法尼亚记忆中心的副主任和现场调查的生物遗传公司的药物临床试验,告诉NBC新闻说他不同意 FDA的决定。 “这是怎么回事提出了患者和医护人员,并是否要开药医生一个真正的挑战,” Karlawish说。 “这是要为研究人员谁正在进行试验也提出了挑战,并计划试验,开发出更好的药物。”对他而言,他说他只会开药“后,曾与有关的显着不确定性,环绕该药物是否工作,甚至对患者及家属交谈。”
根据纽约时报,专家认为,即使药物能减缓某些认知能力下降,效益将是微乎其微的,它不会超过肿胀或在大脑中,这种药物在一些患者在试验中引起出血的危险。
药物的潜在成本高也是造成争议。

虽然生物遗传尚未透露该药物将耗资多少,美联社报道说估计说,这可能是$ 30,000到$ 50,000一年的治疗。同时,初步分析是由该药物只应在$ 2,500到$ 8,300个,每年的定价是基于在一个良好的价值“小整体健康收益。”每个AP的,非营利性的学院为临床和经济评论认为,“任何价格太高,”如果药物的好处是没有后续的研究证实。


