FDA警告说,沃尔玛和亚马逊在55个感染报道后回忆起销售的眼滴。
FDA和CDC正在进行正在进行的调查。

眼滴是 药柜的必要性 对于我们许多人来说,随着春季快速临近,如果您患有花粉症,它们是必须的。 当您的冬季,您可能还会依靠它们 眼睛刺激或干燥 由于天气寒冷。
但是,由于美国食品药品监督管理局(FDA)刚刚发布了两个品牌的眼药水,您将需要仔细检查您的供应。 在亚马逊和沃尔玛都出售的有关滴落导致了55种感染,视力丧失甚至死亡的报告。
请继续阅读以了解哪些品牌受到影响,如果您在家中有什么样的品牌。
接下来阅读此信息: 如果您用眼睛注意到这一点,请检查甲状腺,医生说 。
召回的一部分是两个品牌的眼药水品牌。
FDA和疾病控制与预防中心(CDC)正在研究“ 广泛耐药 “细菌的菌株 铜绿假单胞菌 根据2月1日的健康警报网络健康咨询,疾病预防控制中心。
截至1月31日,来自美国12个州的55例患者发现了这种菌株:加利福尼亚州,科罗拉多州,康涅狄格州,佛罗里达州,新泽西州,新墨西哥州,纽约,内华达州,内华达州,德克萨斯州,犹他州,犹他州,华盛顿和威斯康星州。 根据CDC暴发和患者通知,“普通暴露”似乎是人造泪水眼滴 - 使用 10个不同的品牌 ,最常见的是Ezricare人工眼泪。
鉴于调查, 全球药物医疗保健 FDA于2月2日宣布了其Ezricare,LLC和Delsam Pharma人工眼泪的自愿召回。2。全球制药是“ 完全合作 “与调查人员有关,该公司告诉CBS新闻。”到目前为止,我们尚未确定我们的制造设施是否是污染的根源。 尽管如此,出于谨慎的谨慎,我们回想起有争议的产品。”该公司说。
报道了严重的感染,视力丧失和一名死亡。

疾病预防控制中心说,使用眼睛掉落后,患者报告了眼部炎症,呼吸道感染,尿路感染和败血症。 在某些情况下,这些疾病会导致更严重的结果,包括永久视力丧失,住院和与血液感染有关的死亡。
特定应力 铜绿假单胞菌 细菌称为Verona整合子介导的金属β-内酰胺酶(VIM)和圭亚那延伸的光谱-β-内酰胺酶(GES),后者缩短为vim-gES-crpa。 据疾病预防控制中心(CDC)称,直到现在,这种菌株从未在美国报告。
到目前为止,仅在两个州的Ezricare瓶中发现细菌污染。 疾病预防控制中心说,在使用下降或制造过程中,可能发生污染。 该机构目前正在测试未打开的Ezricare人工眼泪,以确认这是否在制造过程中可能发生。
同样在2月2日,FDA警告客户不要购买Ezricare或Delsam Pharma人工眼泪,并解释说,总部位于印度的Global Pharma Healthcare Private Limited违反了监管机构的 当前良好的制造实践 (CGMP)由于“缺乏适当的微生物测试,配方问题……以及缺乏有关篡改包装的适当控制。根据FDA,该公司被置于进口警报处,这意味着这些产品不能进入美国
有关的: 有关更多最新信息,请注册我们的每日新闻通讯 。
如果您有这些眼药水,请立即停止使用它们。

根据CDC的说法 铜绿假单胞菌 是在 土壤和水 ,并且通常在医疗机构中传播。 它可以感染身体的不同部位,包括眼睛和肺部。 使事情变得更加复杂,由于抗生素耐药性,这些感染变得越来越难以治疗,这意味着细菌对试图杀死它们的药物没有反应。 AE0FCC31AE342FD3A1346EBB1F342FCB
CDC和FDA都表示,您应该停止使用任何召回的眼药水,并且如果您的医疗保健提供者建议品牌,请与他们联系以寻求替代方案。
如果您显示感染的迹象,CDC会敦促您积极主动。 “使用ezricare人工眼泪并具有眼感染的症状或症状的患者,例如眼睛的排出,眼睛疼痛或不适,眼睛或眼睑发红,眼中的感觉,对光的敏感性增加,或 卫生咨询说:“模糊的愿景应该寻求及时的医疗保健。”
但是,如果您使用这些产品并且没有症状,则疾病预防控制中心目前不建议您看到医疗保健提供者。
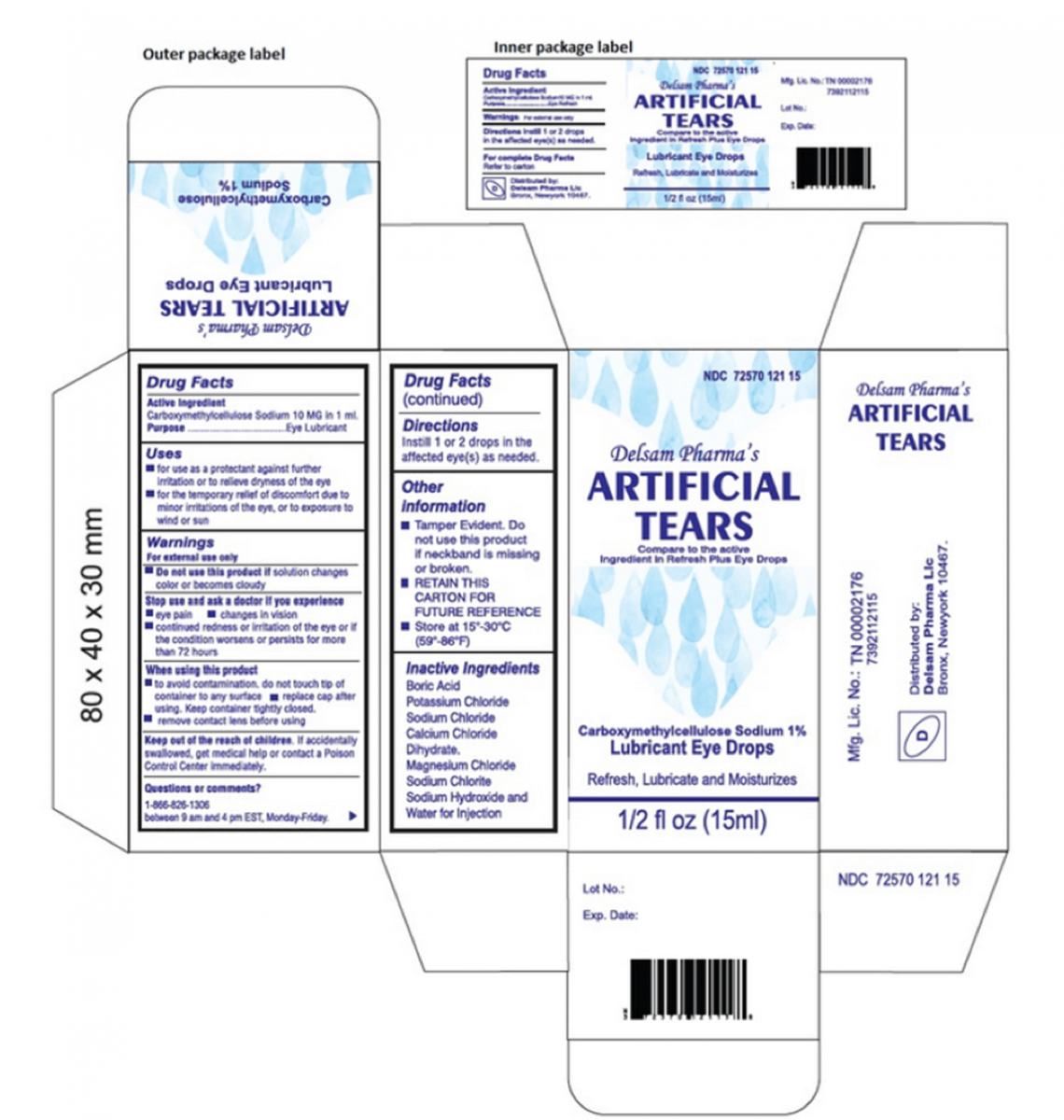
这是识别召回产品的方法。

根据FDA,召回适用于所有未到期的Ezricare和Delsam Pharma人工眼泪。 人造眼泪的眼滴被用来防止刺激或缓解干燥或不适,并具有安全印章,并在柜台上的纸箱盒中出售。
Ezricare分发的人工眼泪的国家毒品法典(NDC)为79503-0101-15,通用产品代码(UPC)为3-79503-10115-7。 由Delsam Pharma分发的NDC为72570-121-15,UPC为72570-0121-15。 UPC在盒子底部的条形码下方印刷,而NDC则在盒子前面的右上角打印出来。
召回公告称,人造眼泪在美国在线出售。 CDC发言人向CBS News以及住院和门诊就诊期间确认,它们是“通过亚马逊和沃尔玛获得的”。 据媒体报道,Ezricare Drops也是去年亚马逊上最畅销的干眼保健产品之一。
Global Pharma Healthcare正在通知两个分销商有关该问题的信息,要求批发商,零售商和客户停止使用产品。 您可以向FDA的MEDWATCH不良事件报告报告不良反应 在线计划 ,,,, 通过邮件 ,或通过传真。


